Подборка по базе: Бизнес-аналитика и финансовое моделирование_Задание 5_МЕНбд-1807, Пар. 29, 30. Строение атома. Объяснение электрических явлений..d, Критерии и показатели оценки модели ученического самоуправления., Информационное моделирование Экспорт_коллизии.pdf, Экономико-ма тематические методы и модели в логистике.docx, Образовательные модели смешанного обучения.docx, Курсовая работа Модели взаимоотношений медицинских работников и , 2 Организации данных ГИС. Модели данных.pdf, Лабораторная №2. Моделирование систем.docx, ПЗ Моделирование экономических процессов 2.docx
1)
| Недостатки модели атома Томсона |
| Большой недостаток модели, а, следовательно, и ее главная ошибка состоит в том, что Томсон считал, что весь положительный заряд был внутри атома |
| Дискретный характер излучения и устойчивость атома никак не объяснялась данной моделью. |
| По этой модели нельзя понять, каковы размеры атомов |
| Противоречила моделям Резерфорда и Бора |
| Модель Томсона обнаруживала сходство с законами Менделеева, но объяснить все химические элементы она не могла |
| Недостатки модели атома Резерфорда |
| Не был объяснен такой факт, как энергетическая устойчивость атома |
| Невозможно было объяснить наблюдаемые оптические спектры атомов. |
| Была не совместима с законами классической физики |
| Энергия перехода с одной орбиты на другую сопровождается тем, что энергия не излучается |
2) В 1913 году Франк и Герц поставили опыт, косвенно подтверждающий теорию Бора: атомы разреженного газа обстреливались медленными электронами с последующим исследованием распределения электронов по абсолютным значениям скоростей до и после столкновения. При упругом ударе распределение не должно меняться, так как изменяется только направление вектора скорости. Результаты показали, что при скоростях электронов меньше некоторого критического значения удары упруги, а при критической скорости столкновения становятся неупругими, электроны теряют энергию, а атомы газа переходят в возбуждённое состояние. При дальнейшем увеличении скорости удары снова становились упругими, пока не достигалась новая критическая скорость. Наблюдаемое явление позволило сделать вывод о том, что атом может или вообще не поглощать энергию, или же поглощать в количествах равных разности энергий стационарных состояний
3) 1 постулат Бора, который также носит название постулата стационарных состояний, гласит: каждому из стационарных (квантовых) состояний, в котором находится атомная система, соответствует определенный уровень энергии Е. Находясь в стационарном состоянии, атом не излучает. 2 постулат Бора также носит название правила частот. Он гласит, что переход атома из одного квантового состояния, характеризующегося энергией En в новое квантовое состояние, которое характеризуется энергией Em, происходит излучение или поглощение кванта энергии.
Энергия кванта при этом определяется как разность энергий двух квантовых состояний:
hνnm=En–Em, где h – постоянная Планка.
Классическая электродинамика не могла объяснить все имевшиеся к тому времени экспериментальные данные (опыты Резерфорда, дискретные спектры атома водорода)
Недостатки теории Бора. Не смогла объяснить интенсивность спектральных линий. Справедлива только для водородоподобных атомов и не работает для атомов, следующих за ним в таблице Менделеева без экспериментальных данных (энергии ионизации или других). Теория Бора логически противоречива: не является ни классической, ни квантовой.
4)
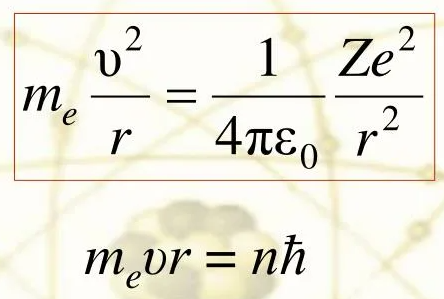
5) Главное квантовое число — целое число, для водорода и водородоподобных атомов определяет возможные значения энергии. В случаях сложных атомов нумерует уровни энергии с фиксированным значением азимутального (орбитального) квантового числа l: {displaystyle l}0{displaystyle n=l+1, l+2, l+3, ldots .}
6)
В науке было много ученых, которые изменили ситуацию, когда дело дошло до понимания того, как все работает. Знания о частицах, атомах и электронах обеспечили много достижений в науке. Поэтому эту статью мы посвятим Атомная модель Томсона. Он также был известен как модель пудинга с изюмом.
В этой статье вы можете узнать все, что связано с атомной моделью Томсона, каковы ее характеристики и насколько она важна для науки.
Индекс
- 1 Что такое атомная модель Томсона
- 2 Эксперимент с золотой фольгой
- 3 Характеристики атомной модели Томсона
- 4 Ограничения и ошибки атомной модели Томсона
Что такое атомная модель Томсона
Эта модель была разработана в 1904 году и, возможно, была открыта первая субатомная частица. Первооткрывателем был британский ученый Джозеф Джон Томсон. Этот человек смог обнаружить отрицательно заряженные частицы в эксперименте, в котором он использовал электронно-лучевые трубки в 1897 году.
Последствия этого открытия были довольно огромными, поскольку не было доказательств того, что у атома может быть ядро. Этот ученый заставляет нас думать, что электроны были погружены в некое вещество с положительным зарядом, которое противодействует отрицательному заряду электронов. Это то, что сделало атомы нейтральными.
Объяснять их понятным образом — все равно что положить желе с плавающим внутри изюмом. Отсюда и название модели пудинг с изюмом. В этой модели Thomson взял на себя ответственность называть электроны корпускулами и считал, что они расположены неслучайным образом. Сегодня известно, что они представляют собой своего рода вращающиеся кольца и что каждое кольцо имеет разный уровень энергии. Когда электрон теряет энергию, он переходит на более высокий уровень, то есть удаляется от ядра атома.
Эксперимент с золотой фольгой
Томпсон думал, что положительная часть атома всегда остается неопределенной. Эта модель, созданная им в 1904 году, не получила широкого академического признания. Пять лет спустя Гейгер и Марсден смогли провести эксперимент с золотой фольгой, который сделал открытия Томсона не столь эффективными. В этом эксперименте они прошли пучок альфа-частиц гелия через золотую фольгу. Альфа-частицы — это не что иное, как львы элемента, то есть ядра, не имеющие электронов и, следовательно, имеющие положительный заряд.
Результатом эксперимента было то, что этот луч рассеивался при прохождении через золотую фольгу. Из этого можно было сделать вывод, что должно быть ядро с источником положительного заряда, которое отвечало за отклонение светового луча. С другой стороны, в атомной модели Томсона положительный заряд распределялся по тому, что было названо желатином и которое содержало электроны. Это означает, что пучок ионов мог пройти через атом этой модели.
Когда в последующем эксперименте было показано обратное, эта модель может быть отвергнута атомный.
Открытие электрона также произошло в рамках другой модели атома, но от Дальтона. В этой модели атом считался полностью неделимым. Именно это побудило Томсона задуматься о своей модели пудинга с изюмом.
Характеристики атомной модели Томсона
Среди основных характеристик этой модели можно выделить следующие:
- Атом, который представляет эта модель напоминает сферу, в которой есть положительно заряженный материал с электронами отрицательно заряженные. Внутри сферы присутствуют и электроны, и положительно заряженное вещество.
- Положительный и отрицательный заряды имеют одинаковую величину. Это означает, что весь атом не имеет заряда, но электрически нейтрален.
- Так что атом вообще может иметь нейтральный заряд электроны необходимо погрузить в вещество, имеющее положительный заряд. Это то, что упоминается в отношении изюма как части электронов, а остальная часть желатина является частью с положительным зарядом.
- Хотя это не объясняется явным образом, можно сделать вывод, что в этой модели атомного ядра не существовало.
Когда Томсон создавал эту модель, он отказался от предыдущей гипотезы об атоме туманности. Эта гипотеза была основана на том факте, что атомы состоят из нематериальных вихрей. Будучи опытным ученым, он хотел создать свою атомную модель на основе экспериментальных данных, известных в его время.
Несмотря на то, что эта модель не была полностью точной, она могла помочь в создании фиксированных баз, чтобы более поздние модели могли быть более успешными. Благодаря этой модели стало возможным проводить различные эксперименты, которые привели к новым выводам, и именно так наука, которую мы знаем сегодня, развивалась все больше и больше.
Ограничения и ошибки атомной модели Томсона
Мы собираемся проанализировать, в чем проблемы, в которых эта модель не преуспела, и почему она не может продолжаться. Во-первых, он не мог объяснить, как заряды сохраняются на электронах внутри атома. Не имея возможности объяснить это, он также ничего не мог решить о стабильности атома.
В своей теории он ничего не упоминал об атоме, имеющем ядро. Если бы сегодня мы знали, что атом состоит из ядро, состоящее из протонов, нейтронов и электронов, вращается вокруг на разных уровнях энергии.
Протоны и нейтроны еще не были обнаружены. Томпсон попытался основать свою модель на объяснении с элементами, которые в то время были научно доказаны. Когда эксперимент с золотой фольгой был подтвержден, от него быстро отказались. В этом эксперименте было показано, что внутри атома должно быть что-то, что могло бы придать ему положительный заряд и большую массу. Уже известно, что это ядро атома.
Я надеюсь, что с этой информацией вы сможете больше узнать об атомной модели Томсона.
Содержание статьи соответствует нашим принципам редакционная этика. Чтобы сообщить об ошибке, нажмите здесь.
Вы можете быть заинтересованы
Модель атома Томсона – одна из ранних моделей строения атома, впоследствии признанная несостоятельной. Впервые предложена Д.Д. Томсоном в 1904 году вскоре после открытия электронов, но до открытия атомного ядра.
Предыстория
В 1897 году в физике произошло знаменательное событие: Томпсон Джозеф Джон открыл электроны, тем самым экспериментально подтвердив предположение, что атом не является «монолитной» частицей. Однако точного представления, что же из себя представляют элементарные частицы, не было. Лишь в 1911 году будет представлена более точная модель атома Резерфорда, а до этого научный мир лихорадочно бился над «загадкой столетия».
Поиск ответа
После серии экспериментов выяснилось, что электроны отрицательно заряжены, а между тем уже было известно, что атомы имеют нейтральный заряд. Томсон разумно предположил, что в атоме должен быть некий источник положительного заряда для компенсации отрицательного заряда электронов.
Английский физик представил три возможных механизма взаимодействия внутри частиц.
- В первой модели атома Томсона каждый отрицательно заряженный электрон прилипал к положительно заряженной частице, которая следовала за ним всюду внутри атома.
- Во второй модели электроны вращаются вокруг центральной области положительного заряда, имеющего такую же величину, что и все электроны.
- В третьей модели электроны занимали область пространства, которая сама была однородным положительным зарядом (часто рассматриваемым как «суп» или «облако» положительного заряда).
Ученый выбрал третий вариант — наиболее вероятную структуру атомов.
Поиск ответа
После серии экспериментов выяснилось, что электроны отрицательно заряжены, а между тем уже было известно, что атомы имеют нейтральный заряд. Томсон разумно предположил, что в атоме должен быть некий источник положительного заряда для компенсации отрицательного заряда электронов.
Английский физик представил три возможных механизма взаимодействия внутри частиц.
- В первой модели атома Томсона каждый отрицательно заряженный электрон прилипал к положительно заряженной частице, которая следовала за ним всюду внутри атома.
- Во второй модели электроны вращаются вокруг центральной области положительного заряда, имеющего такую же величину, что и все электроны.
- В третьей модели электроны занимали область пространства, которая сама была однородным положительным зарядом (часто рассматриваемым как «суп» или «облако» положительного заряда).
Ученый выбрал третий вариант — наиболее вероятную структуру атомов.
Внимание общественности
Модель атома Томсона в 1904 году была опубликована в мартовском выпуске Philosophical Magazine – авторитетном научном журнале Британии. По мнению автора, атомы элементов состоят из ряда отрицательно наэлектризованных корпускул (электронов), заключенных в сферу равномерной положительной электризации. Томсон отказался от более ранней своей гипотезы «туманного атома», в которой частицы состояли из нематериальных вихрей.
Публикация вызвала неподдельный интерес у научного сообщества. Однако прочных доказательств она не имела, а, следовательно, критиковалась многими авторитетными физиками. Впрочем, она соответствовала тем представлениям и экспериментальным данным, которые были известны на то время.
Описание модели
Будучи проницательным и практичным ученым, Томсон основывал свою атомную модель на известных экспериментальных данных. Предложение о положительном объеме заряда отражает характер его научного подхода к открытию, которое стало руководством к действию для будущих экспериментов.
Согласно теории, орбиты электронов внутри атомной модели Томсона были стабилизированы тем, что, когда электрон удалялся от центра положительно заряженной сферы (облака), он подвергался воздействию увеличивающейся силы притяжения. Эта сила возвращает электрон обратно, поскольку по закону Гаусса, внутри сферы более высокая концентрация положительного заряда. Согласно модели, электроны могли свободно вращаться по кольцам, которые были дополнительно стабилизированы взаимодействием между электронами, а спектроскопические значения объясняли энергетические различия между отдельными кольцевыми орбитами.
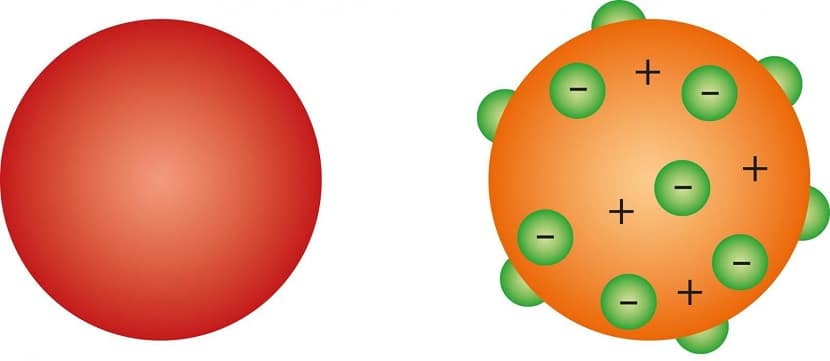
Согласно представлению того времени, электроны располагались в положительно заряженной сфере словно изюминки в пироге, или кусочки фруктов в любимом англичанами десерте – сливовом пудинге. Поэтому концепцию еще называют «пудинговой» моделью атома.
Описание модели
Будучи проницательным и практичным ученым, Томсон основывал свою атомную модель на известных экспериментальных данных. Предложение о положительном объеме заряда отражает характер его научного подхода к открытию, которое стало руководством к действию для будущих экспериментов.
Согласно теории, орбиты электронов внутри атомной модели Томсона были стабилизированы тем, что, когда электрон удалялся от центра положительно заряженной сферы (облака), он подвергался воздействию увеличивающейся силы притяжения. Эта сила возвращает электрон обратно, поскольку по закону Гаусса, внутри сферы более высокая концентрация положительного заряда. Согласно модели, электроны могли свободно вращаться по кольцам, которые были дополнительно стабилизированы взаимодействием между электронами, а спектроскопические значения объясняли энергетические различия между отдельными кольцевыми орбитами.
Согласно представлению того времени, электроны располагались в положительно заряженной сфере словно изюминки в пироге, или кусочки фруктов в любимом англичанами десерте – сливовом пудинге. Поэтому концепцию еще называют «пудинговой» моделью атома.
Дилемма несоответствия
По мере накопления экспериментальных данных все отчетливее наблюдалось несоответствие данной теории. Томсон безуспешно пытался переделать свою модель, чтобы объяснить некоторые из основных спектральных линий, экспериментально выявленных для нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда провели эксперименты с тонким листом золота, рассеивая альфа-частицы на золотой фольге. Данные оказались отличными от ожидаемых. В 1911 году Резерфорд после долгих размышлений опубликовал собственную концепцию, названную впоследствии моделью атома Резерфорда. Он предположил наличие очень маленького ядра с сильнейшим положительным зарядом в центре атомов золота, достаточного для удержания порядка ста электронов.
Дальнейшее развитие
Сразу после того, как Резерфорд опубликовал свои результаты, Антониус Ван ден Брук интуитивно предположил, что атомный номер элемента представляет собой общее количество единиц заряда, присутствующих в его ядре. Генри Мозли в 1913 году предоставил необходимые данные для доказательства предложения Ван ден Брука. Было обнаружено, что эффективный ядерный заряд соответствует атомному номеру.
Данная работа послужила базисом для создания Нильсом Бором полуклассической модели атомов в 1913 году. Она напоминает взаимодействие светила и планет в Солнечной системе, но только с квантовыми ограничениями.
Значение для науки
Модель атома Томсона послужила толчком для стремительного развития ядерной физики. Концепция «сливового пудинга» с одним электроном использовалась физиком Артуром Эрихом Хаасом в 1910 году для оценки численного значения постоянной Планка и боровского радиуса атомов водорода. Работа Хааса была опубликована за три года до выводов Нильса Бора. Следует отметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон.
Кроме того, теория «пудинга» позволяет определить оптимальное распределение равных точечных зарядов на единичной сфере, называемой проблемой Томсона. Кстати, физическая система, воплощенная в проблеме Томсона, является частным случаем одной из восемнадцати нерешенных математических задач, предложенных математиком Стивом Смейлом – «Распределение точек на двумерной сфере».
Проблема Томсона является естественным следствием модели «пучкового пудинга» в отсутствие равномерного положительного фонового заряда. Электростатическое взаимодействие электронов, ограниченных сферическими квантовыми точками, также аналогично их обработке в атомной модели Томсона. В этой классической задаче квантовая точка моделируется как простая диэлектрическая сфера (вместо однородной, положительно заряженной сферы, как в модели «пучкового пудинга»), в которой находятся свободные или избыточные электроны.
Модель атома Томсона — что из себя представляет
Модель атома Томсона является одной из ранних моделей, описывающей строение атома, которая в дальнейшем была признана несостоятельной.
Рассматриваемая модель атома была представлена в 1904 году Д.Д. Томсоном. Открытию предшествовало обнаружение электронов, а после формулировки гипотезы было обнаружено атомное ядро.
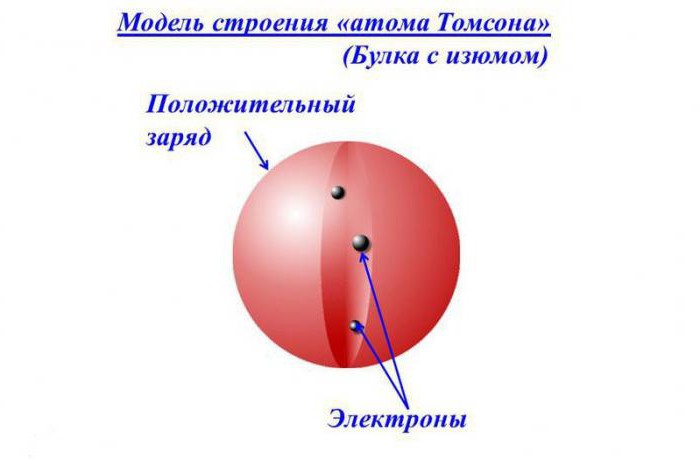
Томсон выдвинул предположение о том, что атом является равномерно распределенным по всему объему зарядом со знаком плюс. Положительно заряженное «облако» содержит внутри небольшие электроны с отрицательным зарядом, расположение которых определено случайно.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Подобная модель напоминает пудинг с изюмом. Общий заряд атома нейтрален, что обусловлено равенством по модулю суммарного заряда электронов и заряда «облака». Данную модель нередко называют «пудинговой моделью атома».
Предыстория открытия, чем отличалась от модели Резерфорда
В физике 1897 год отмечен знаменательным событием. В это время Джозефом Джоном Томсоном были открыты электроны. Таким образом, ученому удалось экспериментальным путем подтвердить гипотезу о том, что атом – не «монолитная» частица. Вместе с тем отсутствовало точное представление о характере элементарных частиц.
В результате серии опытов был определен отрицательный заряд электронов. При этом имелась информация о нейтральном заряде атомов. Томсон выдвинул предположение о наличии некого источника положительного заряда в атоме, что позволяет компенсировать отрицательный заряд электронов. Английским физиком было выдвинуто несколько вероятных механизмов взаимодействия частиц, находящихся внутри атома:
- электрон с отрицательным зарядом присоединяется к частице с положительным зарядом и перемещается вместе с ней;
- электроны совершают вращательные движения вокруг центральной области положительного заряда, который характеризуется такой же величиной, что и все электроны;
- электроны занимают область пространства, являющуюся самостоятельным однородным положительным зарядом.
Ученый остановился на третьем варианте, который казался ему наиболее вероятным, отражающим структуру атомов. Публикация модели атома Томсона состоялась в 1904 году в мартовском выпуске издания Philosophical Magazine. Журнал пользовался авторитетом в Британии.
Мнение автора заключалось в том, что атомы элементов включают в себя определенное количество отрицательно наэлектризованных корпускул или электронов, которые заключены в сферу равномерной положительной электризации. Тем самым, ученый отказался от предшествующей своей теории о «туманном атоме», согласно которой частицы состояли из нематериальных вихрей.
Научное сообщество проявило большой интерес к публикации Томсона. Однако гипотеза столкнулась с критикой со стороны многих авторитетных физиков по причине отсутствия прочных доказательств. С другой стороны, рассматриваемая модель атома полностью отвечала представлениям и результатам экспериментов, которые были известны в то время.
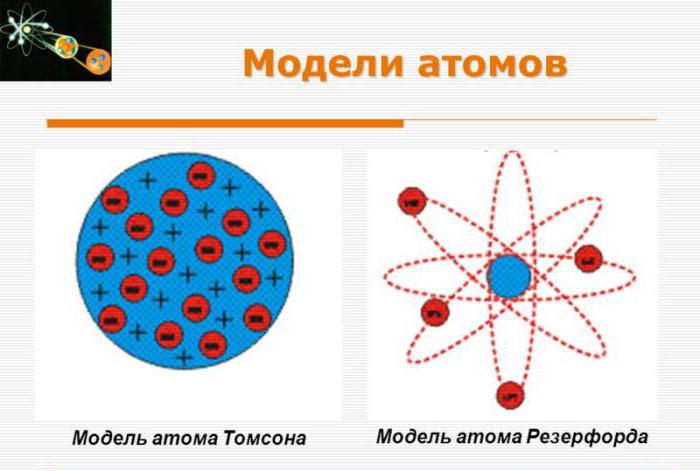
Только в 1911 году была представлена более точная модель атома Резерфорда. Отличие от модели Томсона заключается в том, что, согласно представлениям Резерфорда, положительный заряд расположен в малой области атома, а компенсирующие электроны окружают его. К такому утверждению ученый пришел в результате экспериментов по бомбардировке атомов. В дальнейшем данная модель рассматривалась в качестве планетарной модели атома по Резерфорду.
Как описывал атом Томсон, почему модель назвали «Пудинг с изюмом»
Томсон был известен, как проницательный и практичный ученый. Основываясь на известных экспериментальных данных, он выдвинул гипотезу об атомной модели. Предположение о том, что объем заряда положительный, является отражением научного подхода Томсона к открытию, которое стало руководством к действию для дальнейших экспериментов.
Исходя из теории, стабилизация орбит электронов внутри атомной модели Томсона объясняется воздействием возрастающей силы притяжения на электрон, удаляющийся от центра положительно заряженной сферы или облака. Данное воздействие способствует возвращению электрона, что обусловлено законом Гаусса, подтверждающим более высокую концентрацию положительного заряда во внутренней области сферы.
Рассматриваемая модель предполагает свободное вращение электронов по кольцам, дополнительно стабилизированным, благодаря взаимодействию электронов между собой. С помощью спектроскопических значений объяснялись энергетические различия между отдельными кольцевыми орбитами.
По представлениям тех времен, расположение электронов в сфере с положительным зарядом напоминало изюм в пироге или фруктовые кусочки в сливовом пудинге. В связи с этим концепция приобрела название «пудинговой» модели атома.
Плюсы и минусы теории
Модель Томсона является объяснением излучения атомов. Однако весь комплекс эмпирических данных по спектрам атома не был подтвержден в этой модели. Формулы определенных химических элементов описали их спектры, но противоречили рассматриваемой модели. Таким образом, с помощью модели Томсона не получилось объяснить дискретный характер, которым обладают спектры атомов.
Проблема также заключалась в описании устойчивости атома. Представленная модель не могла охарактеризовать рентгеновское и гамма-излучения, которые испускают атомы. Кроме того, отсутствовали пояснения относительно определения размеров атома. Модель противоречила опытам, направленных на изучение того, как распределяется положительный заряд в атоме. Спустя некоторое время после создания модель Томсона признали ошибочной.
В настоящее время рассматриваемая модель имеет историческое значение и, несмотря на несостоятельность, является важным элементом в цепочке развития научных знаний о строении вещества. В качестве еще одного достоинства модели атома Томсона можно отметить ее простоту. Благодаря этому преимуществу, гипотезу удалось опровергнуть и продвигать науку дальше.
Дилемма несоответствия, дальнейшее развитие
С увеличением объема экспериментальных данных научное сообщество убеждалось в том, что сущность модели атома Томсона не соответствовала действительности. Попытки ученого усовершенствовать выдвинутую гипотезу не увенчались успехом. Томсону не удалось объяснить некоторые из ключевых спектральных линий, которые были выявлены опытным путем при исследовании состава нескольких элементов.
В 1909 году Ганс Гейгер и Эрнест Марсден под кураторством профессора Эрнеста Резерфорда поставили опыты над тонким золотым листом. Схема эксперимента заключалась в рассеивании альфа-частиц на фольге из золота. Полученные данные не оправдали ожидания. В 1911 году Резерфорд по итогу длительных размышлений представил миру собственную концепцию, которая затем получила название «модель атома Резерфорда».
Ученый предположил, что в центральной области атомов золота находится очень маленькое ядро, обладающее мощным положительным зарядом, что позволяет удержать порядка ста электронов.
Сразу после публикации гипотезы Резерфорда было выдвинуто предположение ученым Антониусом Ван ден Бруком о равенстве атомного номера элемента общему количеству единиц заряда, которые присутствуют в его ядре. В 1913 году Генри Мозли предоставил нужную информацию, доказывающую теорию Ван ден Брука. Было установлено соответствие эффективного ядерного заряда атомному номеру.
Исследование легло в основу характеристики полуклассической модели атомов, созданной Нильсом Бором в 1913 году. Данная модель напоминает то, как взаимодействуют Солнце и планеты в Солнечной системе, но при наличии квантовых ограничений.
Благодаря модели атома Томсона, ядерная физика получила стремительное развитие. Концепцию «сливового пудинга» с одним электроном использовал физик Артур Эрих Хаас в 1910 году, чтобы оценить численное значение постоянной Планка и определить боровский радиус атомов водорода.
Хаас опубликовал работу на три года раньше, чем были представлены выводы Нильса Бора. Важно заметить, что боровская модель обеспечивает достаточно точные прогнозы для атомных и ионных систем, имеющих один эффективный электрон. С помощью теории «пудинга» можно рассчитать оптимальное распределение идентичных точечных зарядов на единичной сфере, которую называют проблемой Томсона.
Физическая система, отраженная в проблеме Томсона, представляет собой частный случай одной из восемнадцати математических задач без решения, которые предложил математик Стив Смейл — «распределение точек на двумерной сфере». Проблема Томсона – это естественное следствие модели «пучкового пудинга» в отсутствие равномерного положительного фонового заряда.
Электростатическое взаимодействие электронов, которые ограничены с помощью сферических квантовых точек, идентично их обработке в атомной модели Томсона. Классическая задача подразумевает моделирование квантовой точки как простой диэлектрической сферы со свободными или избыточными электронами, а не однородной сферы с положительным зарядом, которая описана в модели «пучкового пудинга».
Thomson developed his model of the atom in 1904. North Americans would call it a «Christmas cake» model.
He assumed that the electrons were uniformly distributed and free to rotate in rings inside a sphere of positive charge.
These orbits were stabilized because, when an electron moved farther from the centre of the positive cloud, it felt a larger net inward force because caused by all the positive material inside its orbit.
Others (not Thomson) compared it to a British dessert called plum pudding, so his model came to be known as the plum pudding model.
Many North Americans would compare it to the raisins and nuts in a spherical Christmas cake.
Thomson’s model was correct at the time, because it explained all that scientists then knew about the atom.
The Japanese physicist Hantaro Nagaoka rejected Thomson’s model.
He suggested that the atom had a massive nucleus.
The electrons revolved around the nucleus, like the rings revolving around Saturn.
In 1911, Rutherford showed that Thomson’s model was «wrong»: the distribution of positive and negative particles was not uniform.
Rutherford showed that the atom contains a small, massive, positively charged nucleus.
He also agreed with Nagaoka that the electrons move in circular orbits outside the nucleus.
The Rutherford model was the best explanation of atomic structure for his time.
We now know that even the Rutherford model was not completely correct.
Models are not «wrong». Rather, they are the best we have at the time. Scientists change them as new information becomes available.