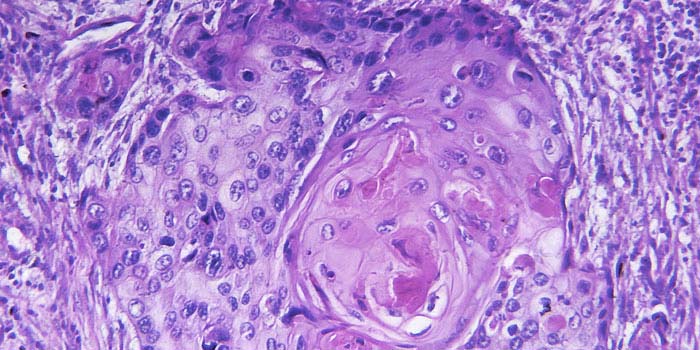
Пересмотр стекол
Москва,
Духовской переулок, 22Б
350015,
Краснодар,
Северная ул, 315
198035,
Санкт-Петербург,
Межевой канал, д.4, лит.А
603155,
Нижний Новгород,
Большая Печёрская ул., д.26
Обновлено: 06 июля 2022
61923
При онкологических заболеваниях материал опухоли берут для гистологического или цитологического исследования. Это необходимо для подтверждения диагноза и определения тактики дальнейшего ведения пациента.
Пересмотр гистологических стекол: опухолевая ткань
Полученный во время операции или на биопсии образец ткани (или клеточный материал) специальным образом фиксируют и окрашивают, чтобы изучить под микроскопом и иммуногистохимическими методами. Последние позволяют даже определить органопринадлежность опухоли. [1]
Что такое блоки и стекла?
Эти термины обозначают ткань, полученную во время биопсии и подготовленную особым образом. В первую очередь образцы заливают раствором формалина и проводят специальную обработку. Это нужно для того, чтобы зафиксировать материал, чтобы клетки не разрушились. Затем ткани необходимо придать нужную степень плотности. Для этого ее помещают в парафин – так получаются гистологические блоки.
Гистологические блоки, образец ткани помещен в парафин
Но и такие образцы пока еще не готовы к исследованию. Ткань в блоке нельзя рассмотреть под микроскопом, потому что она не пропускает свет, а слои клеток накладываются друг на друга. Чтобы ткань стала прозрачной и доступной для изучения, блок нужно нарезать на очень тонкие слои с помощью специального инструмента – микротома. Эти тоненькие слои помещают на стекла и фиксируют – получаются гистологические стёкла. [2,3]
Гистологические стекла
Если у пациента обнаружен рак, то лаборатория обязана хранить гистологические блоки пожизненно, а если патологии не выявлено – в течение пяти лет. Гистологические стекла при диагностированном онкологическом заболевании тоже хранятся пожизненно. Если нужно выполнить пересмотр, то можно обратиться в лабораторию, где проводилось исследование, и получить оба этих вида материала. [4]
Когда и почему необходим пересмотр стекол?
Если морфологическое заключение не соответствует клинической картине опухоли, а также снимкам МРТ или КТ, то стекла отправляют на пересмотр в другое лечебное учреждение. Обычно пересмотром стекол занимаются специалисты с многолетним стажем работы и уникальным опытом диагностики редких опухолей. Дополнительный ручной пересмотр исключает возможность ошибки, связанной с использованием автоматических анализаторов.
Почему могут возникать ошибки при первичном просматривании стекол?
- неправильный забор материала, например, захвачен не весь слой эпителия, и невозможно судить о глубине поражения;
- проведена биопсия участка здоровой ткани;
- некачественная обработка материала в лаборатории;
- малое количество изученных срезов;
- недостаточная квалификация патоморфолога. [5]
Качественное микроскопическое и иммуногистохимическое исследование позволяет начать оправданное и своевременное лечение опухоли, а значит, увеличивает шансы на излечение и выживаемость пациента при онкологических заболеваниях. Оптимально, если морфологический диагноз будет подтвержден двумя специалистами.
Список литературы:
- Tatyana S. Gurina; Lary Simms. Histology, Staining. Treasure Island (FL): StatPearls Publishing; 2021 Jan-.
- В. А. Корьяк, Л. А. Николаева. Основы гистологической техники. Учебное пособие.
- Гистологическое изучение микропрепаратов тканей и органов. Гистология, эмбриология, цитология. Под ред. д.м.н., доц. Н. Ю. Матвеевой. Владивосток, Медицина ДВ, 2015.
- Приказ МЗ РФ № 179н от 24.03.2016 г. «О правилах проведения патолого-анатомических исследований».
- P. Morelli, E. Porazzi, M. Ruspini, U. Restelli, and G. Banfi. Analysis of errors in histology by root cause analysis: a pilot study. J Prev Med Hyg. 2013 Jun; 54(2): 90–96.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Третьякова Ю.И.
1
Патрикеева М.С.
1
Меньшикова Н.С.
1
1 ФГБОУ ВО Пермский государственный медицинский университет им. ак. Е.А. Вагнера Минздрава России
В статье представлен клинический случай с описанием пациента 28 лет с агрессивным течением перстневидно-клеточного рака желудка, диагностированного на последней стадии. Из анамнеза известно, что в течение 2,5 месяцев больной наблюдался с диагнозом «гастропатия, индуцированная нестероидными противовоспалительными препаратами (НПВП), с назначением ингибиторов протонной помпы». В связи с ухудшением состояния и неэффективностью терапии пациент был госпитализирован в гастроэнтерологическое отделение клиники. На рентгенографии желудка были выявлены признаки инфильтративных изменений стенок желудка и канцероматоз брюшины. По данным фиброгастроскопии — слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации. По результатам патогистологического исследования выявлен недифференцированный аденогенный рак с образованием перстневидных клеток. Больному проведен один курс полихимиотерапии в краевом онкодиспансере без положительного эффекта. Пациент скончался в связи с прогрессированием основного заболевания и развитием полиорганной недостаточности. Был поставлен заключительный патологоанатомический диагноз: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b. В заключение статьи даны рекомендации по мерам профилактики онкологических заболеваний.
клинический случай
рак желудка
поздняя диагностика
перстневидно-клеточный рак
онкология.
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 250 с.
2. Абдуллаев А.Г., Аллахвердиев А.К., Бесова Н.С., Бяхов М.Ю., Горбунова В.А., Давыдов М.И., Давыдов М.М., Ибраев М.А., Карселадзе А.И., Кувшинов Ю.П., Малихова О.А., Неред С.Н., Стилиди И.С., Трякин А.А. Клинические рекомендации по диагностике и лечению больных раком желудка. Ассоциация онкологов России, 2017. 40 с.
3. Денисов И.Н., Артемьева Е.Г., Маленкова В.Ю., Бусалаева Е.И. Рак желудка. Руководство для врачей общей практики (семейных врачей). Ассоциации врачей общей практики РФ, 2015. 14 с.
4. Белковец А.В., Курилович С.А., Решетников О.В. Наследственный рак желудка (научный обзор) // Международный журнал прикладных и фундаментальных исследований. 2016. № 1-4. С. 516-522.
5. Джемал А., Паоло В., Брей Ф., Торре Л., Форман Д. Атлас современной онкологии. Издание второе. Американское онкологическое общество, 250 Williams Street, Atlanta, Georgia 30303 USA (США), 2014. 136 с.
6. Бойкова С.П., Зайратьянц О.В., Зотова Л.А. Патологическая анатомия: атлас: учеб. пособие для студентов медицинских вузов и последипломного образования. М.: «ГЭОТАР-Медиа», 2014. 961 с.
7. Рыбакова Д.В., Давыдов М.М., Казанцев А.П., Керимов П.А., Матинян Н.В. Рак желудка у пациента 16 лет: описание клинического случая // Онкопедиатрия. 2017. Т. 2. №4. С.147–151.
8. Вашакмадзе Л.А., Филоненко Е.В., Бутенко А.В., Кириллов Н.В., Хомяков В.М. Отдаленные результаты хирургического лечения больных местнораспространенным и диссеминированным раком желудка в сочетании с интраоперационной фотодинамической терапией. // Фотодинамическая терапия и фотодиагностика. 2013. Т. 1. №2. С.3-10.
9. Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2017 году. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 236 с.
10. Бойцов С.А., Чучалин А.Г., Арутюнов В.Г. Биличенко Т.Н., Бубнова М.Г., Ипатов П.В., Калинина А.М., Карпин А.Д., Марцевич С.Ю., Оганов Р.Г., Погосова Н.В., Старинский В.В., Стаховская Л.В., Ткачева О.Н., Чиссов В.И., Шальнова С.А., Шестакова М.В. Профилактика хронических неинфекционных заболеваний. Клинические рекомендации. Москва. 2013. 136 с.
Смертность от онкологических заболеваний занимает второе место после болезней сердечно-сосудистой системы. В 2017 г. в России выявлено почти 541 тыс. онкобольных, а умерло 290,7 тыс., что составило 15,9% в общей структуре смертности [1, с. 3].
В последние годы отмечается тенденция к снижению заболеваемости раком желудка (РЖ), тем не менее в структуре заболеваемости злокачественными новообразованиями населения России РЖ занимает 4-е место у мужчин (7,6%) и 5-е место у женщин (4,7%) [1, с. 9, 10]. Пик заболеваемости приходится на возраст старше 50 лет. Злокачественные новообразования желудка занимают вторую позицию в структуре смертности у мужчин и женщин. Ежегодно в РФ регистрируют около 36 тыс. новых случаев РЖ, и более 34 тыс. больных умирает от этого заболевания. Этиология заболевания до конца не выяснена [2, с. 6].
Имеется связь возникновения патологии с определенными факторами риска. Их можно разделить на немодифицируемые: пол (мужчины страдают чаще), возраст (по мере увеличения возраста увеличивается частота возникновения РЖ), генетическая предрасположенность (5–10% пациентов, страдающих РЖ, имеют отягощенный семейный анамнез); и модифицируемые: инфекция Helicobacter Pylori (HP), характер рациона, ожирение, курение, алкоголь, профессиональная деятельности [3, с. 4-6].
В настоящее время установлено, что почти 90% случаев РЖ в мире обусловлено инфицированием бактерией HP. При этом средства лечения HP-инфекции существуют, но широко не применяются из-за недостатка подтвержденных данных эффективности в профилактике рака желудка и высокой стоимости [5, с. 22]. К возникновению РЖ могут привести фоновые заболевания: хронический атрофический гиперпластический гастрит, аденоматозные полипы, пернициозная анемия, состояния после резекции желудка, болезнь Менетрие [2, с. 6]. Различают три гистологических типа РЖ (по Lauren, 1965 г.): кишечный, диффузный, смешанный. При диффузном раке опухоль представлена слабоорганизованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки). Для данного типа характерен диффузный инфильтративный рост [2, с. 7].
Перстневидно-клеточный рак желудка содержит не менее половины клеток с признаками внутриклеточного образования слизи. Скапливающаяся в цитоплазме слизь сдвигает ядро к периферии, и клетка приобретает сходство с перстнем [6, с. 589]. Согласно результатам клинических наблюдений неблагоприятный прогноз при диффузном раке желудка связывают с низкой выявляемостью на ранних стадиях, быстрым течением, более злокачественным потенциалом опухолевых клеток и ранним метастазированием [7].
Приводим случай летального исхода пациента с перстневидно-клеточным раком желудка, диагностированным на последней стадии.
Клиническое наблюдение. Пациент В., 28 лет, поступил в гастроэнтерологическое отделение клинической медико-санитарной части г. Перми 14.11.2017 г. с жалобами на постоянные боли в области правого фланка живота, преимущественно в нижней части; интенсивные боли в правом подреберье и правом боку при глубоком дыхании; тошноту, рвоту желчью, вздутие живота, Также пациента беспокоили отсутствие аппетита, отвращение к пище, жидкий стул 2–3 раза в сутки без примесей. Отмечались выраженная общая слабость, повышение температуры тела до 37,4°С. За 1 месяц больной похудел на 13 кг.
Анамнез. В начале сентября 2017 г. больной получал терапию антибактериальными и нестероидными противовоспалительными препаратами (НПВП) по назначению стоматолога (после экстракции зуба) в течение 7 дней. В начале октября 2017 г. были вновь назначены антибактериальная терапия и НПВП по поводу гайморита. На фоне приема препаратов появились боли в эпигастрии, изжога, неустойчивый стул. Больной обратился в поликлинику по месту жительства, где обследовался у участкового терапевта. 7 октября 2017 г. выполнена фиброгастродуоденоскопия (ФГДС), на которой выявлены множественные язвы желудка (6 дефектов), язва двенадцатиперстной кишки (ДПК) в стадии эпителизации, застойная гастропатия, дуоденогастральный рефлюкс. Уровень антител к HP составил 1,44. Получал терапию ингибиторами протонной помпы (ИПП), антацидами без эффекта – сохранялись тошнота и абдоминальный болевой синдром с локализацией в эпигастрии.
Участковым терапевтом дано направление на экстренную госпитализацию в терапевтическое отделение городской больницы с диагнозом: Множественные язвы желудка и язва луковицы ДПК, ассоциированные с HP. Гастринома? Синдром Золлингера–Эллиссона?, где больной находился с 12.10.2017 г. по 24.10.17 г. При обследовании в общем анализе крови (ОАК) от 13.10.2017 г.: гемоглобин – 157 г/л; умеренное повышение лейкоцитов до 11х109/л; ускоренная скорость оседания эритроцитов (СОЭ) – 40 мм/час. В биохимическом анализе крови от 13.10.2017 г. общий белок, амилаза, холестерин, печеночные тесты, электролиты крови в пределах нормальных значений. На ультразвуковом исследовании органов брюшной полости (УЗИ) от 13.10.2017 г. выявлены признаки диффузных изменений видимых участков поджелудочной железы. Кал на скрытую кровь – слабоположительный.
23.10.2017 г. выполнена повторная ФГДС: слизистая желудка диффузно гиперемирована с выраженным отеком, утолщена, сосудистый рисунок смазан. Слизистая оболочка в области привратника отечна, гиперемирована. По всем стенкам множественные точечные лимфоидные высыпания. Заключение: Диффузный катаральный гастрит выраженной степени активности. Дуоденогастральный рефлюкс. Диффузный катаральный бульбит выраженной степени активности. Косвенные признаки панкреатита. Гистологическое исследование не проводилось.
В стационаре по результатам обследований был поставлен диагноз: Язвенная болезнь желудка, луковицы ДПК. Множественные острые язвы желудка в активной стадии. НПВП-ассоциированная гастропатия. Язва луковицы ДПК в стадии эпителизации. Больной получал терапию спазмолитиками, ИПП 40 мг в сутки, антацидами.
На фоне лечения отмечалась положительная клиническая и эндоскопическая динамика в виде уменьшения болевого синдрома и эпителизации язвенных дефектов. Пациент был выписан из стационара с рекомендациями продолжить прием ИПП в дозе 40 мг в сутки и явиться на прием к участковому терапевту.
После выписки боли в эпигастрии усилились, появилась острая боль справа в боку в области ребер. Участковый терапевт назначил прием прокинетика, антацидных препаратов, НПВП внутримышечно (в/м) № 3. 4.11.2017 г. у пациента внезапно возникла острая боль в области верхнего левого фланка живота и межреберьях, связанная с дыханием. Больной обратился в приемное отделение клинической больницы, где был поставлен диагноз: Межреберная невралгия. Проведена терапия НПВП в/м, и больной был отпущен домой под наблюдение невролога и терапевта с рекомендациями приема НПВП. Далее по назначению гастроэнтеролога поликлиники принимал висмута трикалия дицитрат, спазмолитики, даларгин без эффекта – сохранялись абдоминальный болевой синдром, неустойчивый стул; также появились выраженное вздутие живота, рвота, отвращение к пище, прогрессирующее похудание. 13.11.2017 г. выполнена ректороманоскопия: стенка прямой кишки с трудом расправлялась воздухом, с эрозиями, утолщенными складками, сосудистый рисунок смазан. Заключение: эрозивно-катаральный проктосигмоидит.
14.11.2017 г. пациент был экстренно госпитализирован в гастроэнтерологическое отделение клиники для дальнейшего обследования и лечения.
Из анамнеза жизни известно, что пациент рос и развивался соответственно возрасту. Курил в течение 8 лет по 10 сигарет в день. Профессиональных вредностей не было. Со слов больного, ранее лечился по поводу мочекаменной болезни. Наследственность по заболеваниям органов пищеварения не отягощена.
При физическом исследовании обращала на себя внимание бледность кожных покровов с сероватым оттенком. Кожа чистая, отеков не отмечалось. Пульс – 92 удара в минуту, ритмичный. Тоны сердца ясные, ритм правильный. Дополнительные шумы не выслушивались. Дыхание везикулярное, ослаблено в нижних отделах, хрипы не выслушивались. Перкуторный звук несколько притуплен в нижних отделах легких. ЧДД – 16 в минуту.
Язык обложен бело-желтым налетом у корня, влажный. Живот плотный, увеличен за счет вздутия и асцита; пальпация резко болезненная в эпигастрии, в области правого фланка живота, по ходу толстой кишки. Ординаты Курлова 10х8х7 см. Стул оформленный, чередующийся с кашицеобразным, без патологических примесей, 1–2 раза в сутки. Со стороны почек и мочевого пузыря без видимой патологии.
Результаты лабораторно-инструментальных исследований представлены ниже.
ОАК: эритроциты 4,7х109/л, гемоглобин 140 г/л, среднее содержание гемоглобина (ССГ) 29%, тромбоциты 307х109/л, лейкоциты 8,4х/л, палочкоядерные нейтрофилы 7%, сегментоядерные нейтрофилы 75%, лимфоциты 15%, моноциты 3%, повышение СОЭ до 43 мм/час.
ОАМ: цвет – желтый, мутная, pH 6,0, умеренная протеинурия 0,39 г/л, лейкоциты 4–6 в поле зрения (п/з), эритроциты 0–1 в п/з, эпителий 2–3 в п/з, слизь +.
Биохимический анализ крови от 15.11.2017 г.: глюкоза 4,8 ммоль/л, Ca 2,29 ммоль/л, AСТ/АЛТ 16/18 Ед/л, ГГТП 84 Ед/л, ЩФ 285 Ед/л, общий белок 54 г/л, альбумины 27 г/л, билирубин общий 12 мкмоль/л, прямой 4,1 мкмоль/л, холестерин общий 3,7 мкмоль/л, калий 4,5 ммоль/л, натрий 134 ммоль/л, креатинин 51 ммоль/л, резкое повышение С-реактивного белка (СРБ) 105 мг/л, снижение железа сыворотки до 4,5 мкмоль/л, повышение общей железосвязывающей способности сыворотки до 75, незначительное повышение прокальцитонина до 0,2 нг/мл. При форезе белков выявлены снижение альбумина до 37,95% и повышение α1-глобулинов до 8,77%, α2-глобулинов до 13,28%, β-глобулинов до 18,5 3%, γ-глобулин 21,47%.
Коагулограмма от 15.11.2017 г.: протромбиновое время 14,9 секунд (11–15 секунд), тромбиновое время – 17,2 секунд, активированное частичное протромбиновое время – 28 секунд (24–35 секунд), резкое повышение фибриногена до 9,56 г/л.
Копрограмма от 16.11.2017 г.: консистенция жидкая, цвет темно-коричневый, переваренные мышечные волокна 0–1–2 в п/з, неизмененные мышечные волокна 0–1 в п/з, форменные элементы крови 0–1 в п/з, лейкоциты 10–20 в п/з, эпителий плоский – единичный в п/з, нейтральных жиров нет, жирных кислот нет, крахмал внеклеточно скудно, йодная флора +, детрит +++.
ФГДС от 14.11.2017 г.: складки желудка гипертрофированные, отечные. Слизистая желудка ярко гиперемирована, плотная при инструментальной пальпации, ранимая при контакте с линейными рубцами неправильной формы. Луковица ДПК деформирована, рыхлая с увеличенными эрозированными фолликулами, на верхушках – фибрин. Заключение: Болезнь Крона? Дуоденогастральный рефлюкс. Косвенные признаки панкреатита. Выполнена биопсия.
Результаты патогистологического исследования слизистой желудка (20.11.2017 г.): в слизистой оболочке пилородуоденальной области очаговое скопление крупных клеток округлой и овальной формы, со светлой слизьсодержащей цитоплазмой, периферически расположенными уплощенными ядрами, единичные клетки с гиперхромными ядрами, скудной цитоплазмой. Диагноз: недифференцированный аденогенный рак с образованием перстневидных клеток.
16.11.2017 г. выполнена КТ органов брюшной полости. Выявлен выпот в реберно-диафрагмальные синусы с обеих сторон. Желудок в области тела и антрального отдела с неравномерно утолщенными стенками до 0,8 см. Большой сальник в области эпигастрия уплотнен, с узловыми образованиями. В брюшной полости большое количество свободного выпота. Заключение: Признаки двустороннего гидроторакса, инфильтративных изменений стенок желудка. Большой сальник в эпигастральной области уплотнен с узловыми образованиями (канцероматоз брюшины). Асцит. Аденопатия гепатодуоденальных лимфатических узлов.
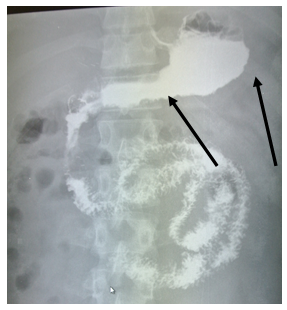
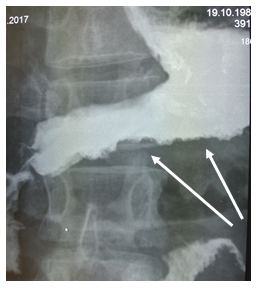
На рентгеноскопии пищевода, желудка, ДПК с бариевой взвесью диагностировано стойкое сужение просвета тела, синуса, выходного отдела желудка (рис. 1) с неровными фестончатыми контурами, атипичным рельефом слизистой (рис. 2). Заключение: Рентгенологические признаки инфильтративного поражения желудка.
Рис. 1. Рентгенологическое исследование желудка пациента В., 28 лет: сужение просвета тела, синуса, выходного отдела желудка
Рис. 2. Рентгенологическое исследование желудка пациента В., 28 лет: неровность и фестончатость контуров, атипичный рельеф слизистой
В условиях стационара проводилась инфузионная, антибактериальная, спазмолитическая, обезболивающая терапия. Амитриптилин 6,25–12,5 мг на ночь. Больной выписан из отделения 22.11.2017 г. с диагнозом:
Основной: Недифференцированный аденогенный рак выходного отдела желудка IV ст. Сопутствующий: Эрозивно-катаральный проктосигмоидит.
Осложнения: Канцероматоз брюшины. Аденопатия гепатодуоденальных лимфоузлов. Асцит. Двусторонний гидроторакс. Дефицит железа.
Пациенту выдано направление в онкологический диспансер. Даны рекомендации приема Амитриптилина 25 мг на ночь; Прегабалина 75 мг 1 раз в день; Нейробиона по 1 табл. 3 раза в день.
С 23.11.2017 г. по 30.11.2017 г. пациент находился в краевом онкологическом диспансере, где был подтвержден диагноз: Злокачественное новообразование желудка (ЗНО) IV ст. Т4NxMx».
Проведен 1 курс полихимиотерапии (ПХТ). После выписки, несмотря на проводимое лечение, состояние пациента прогрессивно ухудшалось. 18.12.2017 г. проведена эвакуация 10 литров асцитической жидкости в условиях стационара. 20.12.2017 г. – консультативный прием в онкологическом диспансере. Диагноз: Злокачественное новообразование желудка IV ст. Т4NxMx. Тотальное поражение. Канцероматоз брюшины. Прогрессирование. Кахексия. Асцит. Было рекомендовано продолжить симптоматическую терапию по месту жительства, а также попытка проведения гастростомии. Учитывая тяжесть состояния, ПХТ не показана.
22.12.2017 г. больной отметил появление одышки. На следующий день самостоятельно обратился в приемное отделение краевой больницы и был госпитализирован в отделение торакальной хирургии. На КТ органов грудной клетки (23.12.2017 г.) выявлен двусторонний гидроторакс. По легочным полям определялись очаги уплотнения по типу «матового стекла».
23.12.2017 г. и 25.12.2017 г. – плевральная пункция – эвакуирован 1 л серозно-геморрагического отделяемого. 26.12.2017 г. состояние больного тяжелое, с отрицательной динамикой. Появились рвота темной кровью, боли в эпигастрии, слабость, сухость во рту. На ФГДС – кровотечение интрагеморрагическое. Эрозивный эзофагит. Гемостаз системой EndoClot.
27.12.2017 г. состояние было крайне тяжелым. Сохранялась рвота темной кровью. Пациент переведен в ОРИТ, где проводилась инфузионная терапия, получал Метоклопрамид, Трамадол, Кетопрофен, Верошпирон, Транексам, Нексиум. При обследовании нарастала тромбоцитопения – 11569-41-19х109л, показатели очищения: мочевина 20,01 ммоль/л; креатинин 140,9 ммоль/л; гипопротеинемия 46,4 г/л.
27.12.2017 г. в 22:15 – асистолия. Реанимационные мероприятия в полном объеме – без эффекта.
27.12.2017 г. в 22:45 констатирована биологическая смерть. Труп В., 28 лет, был направлен на патологоанатомическое исследование с диагнозом: Перстневидноклеточный рак желудка с переходом на нижнюю треть пищевода T4NхM1. Канцероматоз плевры. Метастатическое поражение легких. Двусторонний экссудативный плеврит. Асцит. Осложнения: Кахексия. Желудочно-кишечное кровотечение. Геморрагический шок. Синдром полиорганной недостаточности.
Патологоанатомический диагноз:
Основное заболевание: Злокачественное новообразование желудка: низкодифференцированная аденогенная карцинорма G3-4 (перстневидно-клеточный вариант – гистологически) с метастазами в парааортальные, периэзофагальные лимфоузлы, легкие, надпочечники; канцероматоз плевральных полостей и брюшины рТ4N3M1b.
Осложнение основного заболевания: Отек головного мозга. Двусторонний гидроторакс (1200/1200 мл). Асцит 3500 мл. Кахексия. Венозное полнокровие и паренхиматозная дистрофия миокарда, печени, почек.
Сопутствующие заболевания: Хронический пиелонефрит, ремиссия.
Обсуждение. В структуре заболеваемости РЖ возрастает доля молодого контингента больных (до 45 лет) с преобладанием низкодифференцированных и сложных форм, характеризующихся крайне плохим прогнозом [7, 8]. В настоящее время показатели несвоевременной диагностики рака желудка (IV стадия) являются одними из лидирующих, составляя в России 39,9% [9, с. 10].
Врач первичного звена является первой линией защиты в борьбе с онкопатологией. Первичная профилактика направлена на выявление и устранение влияния неблагоприятных факторов окружающей среды (канцерогенов) на процесс возникновения злокачественной опухоли, а также на устранение модифицируемых факторов риска [10]. У описанного нами пациента к факторам риска можно отнести длительный стаж курения и инфекцию НР.
Вторичная профилактика направлена на выявление и устранение предраковых заболеваний и диагностирование злокачественного новообразования на ранней стадии процесса при помощи ряда лабораторных и инструментальных методов обследования, включая полное гистологическое и молекулярно-генетическое исследование. При этом важно помнить о «симптомах тревоги» [10]. У пациента имели место снижение массы тела и повышение СОЭ, что должно было насторожить врачей. В течение 1,5 месяцев пациента вели с диагнозом «НПВП-гастропатия» с назначением ИПП, которые могли маскировать клинику рака желудка. Кроме того, отсутствие анамнестических данных о наличии фоновых заболеваний желудка и наследственной предрасположенности, молодой возраст пациента, неспецифическая симптоматика в начале заболевания, а также несвоевременное гистологическое исследование слизистой желудка послужили причиной поздней диагностики.
Заключение. Важно помнить, что рак желудка может быть диагностирован и в молодом возрасте, имея при этом крайне агрессивное течение. Необходимо выделять группы риска и своевременно проводить скрининг онкологических заболеваний. Регулярное диспансерное наблюдение является важнейшей массовой и высокоэффективной медицинской технологией сбережения здоровья и снижения преждевременной смертности населения.
Библиографическая ссылка
Третьякова Ю.И., Патрикеева М.С., Меньшикова Н.С. ПОЗДНЯЯ ДИАГНОСТИКА РАКА ЖЕЛУДКА У ПАЦИЕНТА 28 ЛЕТ (СЛУЧАЙ ИЗ ПРАКТИКИ) // Современные проблемы науки и образования. – 2018. – № 6.
;
URL: https://science-education.ru/ru/article/view?id=28401 (дата обращения: 13.06.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Рак желудка представляет собой один из самых распространенных видов онкологических заболеваний. Эффективное, информативное и точное средство диагностики этого и ряда других заболеваний – гистологическое исследование тканей желудка. Гистологический анализ подразумевает взятие образцов тканей желудка посредством биопсии и их микроскопическое исследование. Эта процедура дает врачу возможность поставить точный диагноз и назначить оптимальное лечение. Прежде всего, биопсия тканей желудка и их гистологическое исследование обязательно производится, если врач подозревает у пациента опухоль. Гистологический анализ предоставляет информацию о типе новообразования, клеточном составе опухоли. Если расшифровка результатов гистологии желудка дает положительный результат (наличие злокачественной опухоли), он расценивается как окончательный диагноз. Важно понимать, что плохой анализ гистологии – еще не приговор, так как многие виды опухолей, обнаруженные своевременно, успешно излечиваются. Если же результат отрицательный, нельзя исключать ошибку, виной которой может быть несовпадение местонахождения раковых клеток и места взятия биоптата. Если результат гистологического исследования отрицательный, однако симптомы опухолевого процесса присутствуют, процедура повторяется.
Показания для проведения гистологического исследования
— гипоацидный гастрит (это заболевание желудка считается предраковым);
— диагностика особых форм гастрита (гранулематозный, эозинофильный, лимфоцитарный гастрит);
— хроническая язвенная болезнь;
— дисфагия;
— пищевод Барретта;
— снижение веса, отсутствие аппетита, малокровие;
— стабильный дискомфорт в желудке, отвращение к мясной пище и другие.
Как подготовиться к эндоскопическому исследованию
— Лучшее время для проведения биопсии с последующим гистологическим анализом – утро. Исследование должно проводиться натощак, накануне вечером допустим лишь легкий ужин, исключается употребление жареной, жирной пищи.
— Необходимо прекратить принимать препараты, в которых содержится активированный уголь, железо.
— Накануне гистологического исследования исключаются жевательные резинки, курение. Мнительным пациентам показан прием успокоительных препаратов за день до процедуры.
Процедура забора биоптата
Биопсия забирается в ходе эндоскопического исследования. При этом врач вводит через рот и пищевод в желудок эндоскоп, который снабжен камерой и небольшими щипцами. При помощи камеры врач определяет подозрительные места на слизистой желудка, из которых необходимо взять биопсию. Затем подводит эндоскоп к данным дефектам, и при помощи щипцов откусывает небольшие кусочки. Поскольку в ходе биопсии отрываются небольшие кусочки, данная процедура практически безболезненная. После забора всех необходимых кусочков эндоскоп выводится наружу. Кусочки обрабатываются, как гистологические препараты, а затем врач-патологоанатом изучает их под микроскопом, выявляя наличие или отсутствие атипических (раковых) клеток. Иногда даже опытные специалисты не в состоянии взять кусочки из всех частей язвы. В этом случае необходимо провести биопсию повторно через некоторое время. Правильная биопсия является множественной, то есть врач забирает несколько кусочков для исследования из краев и дна каждого язвенного дефекта. Кроме того, забирается несколько кусочков из каждого рубца, видимого на месте зажившей язвы. Также рекомендуется забирать по нескольку кусочков биопсии из каждого подозрительного места на слизистой оболочке желудка. В настоящее время доказано, что 100%-я точность диагностики рака достигается забором не менее 6 кусочков из разных частей каждого язвенного и рубцового дефекта. Исследование только 1 – 2 кусочков является неинформативным, поскольку позволяет обнаружить рак на ранних стадиях только в половине случаев.
Стоимость и срок исследования
| Наименование | Срок | Стоимость, руб. |
|---|---|---|
| Гистологическое исследование биопсийного материала | от 3 дней | 5000* |
| Гистологическое исследование операционного материала | от 3 дней | 19500* |
* Организация и оплата доставки сырого материала (не в блоках) осуществляется клиентом.
По всем возникшим вопросам Вы можете проконсультироваться у нашего медицинского администратора по телефону: 8-800-555-92-67 или написать нам в WhatsApp: +7 925 740 05 87
Взятие биологического материала и его тщательный гистологический анализ очень значимы во многих отраслях медицины. С целью выявления патологии может назначаться, например, гистология родинки, шейки матки, органов пищеварительного тракта, эндокринной системы и так далее. На наши вопросы о гистологии ответил врач — онколог-маммолог «Клиники Эксперт» Воронеж Сергей Викторович Ежов.
— Сергей Викторович, расскажите, что это за анализ — гистология? В чём его суть?
— Гистологический анализ — это высокоточный метод исследования, позволяющий определить патологическое отклонение в строении ткани. Данный метод используется во многих областях медицины, но его основная суть заключается в том, что с помощью этого метода можно диагностировать наличие злокачественных образований, определить их структуру, а также стадию патологического процесса.
— Что может являться биоматериалом для гистологического исследования?
— Биоматериалом может служить та или иная подозрительная ткань (кожа, слизистая оболочка, мышца, кость), взятая при помощи биопсии, либо препарат, полученный в результате хирургического вмешательства.
— Когда назначается гистология?
— Как я уже говорил, гистологическое исследование может применяться во многих направлениях медицины, но особенная его ценность заключается в определении природы и характера изменений в ткани при малейшем подозрении на онкологический процесс. Также это исследование проводят перед назначением противоопухолевой терапии для разработки плана лечения и во время лечения с целью контроля его эффективности.
— Что показывает гистология?
— Гистологический анализ даёт возможность обнаружить воспалительные процессы в ткани, установить природу того или иного новообразования (т. е. доброкачественное оно или злокачественное), определить уровень злокачественности, а также выявить локализацию первичного опухолевого очага. Надо понимать, что расшифровкой результатов гистологического исследования должен заниматься только специалист. Я бы не рекомендовал пациентам делать это самостоятельно.
Взятие биологического материала и его тщательный гистологический анализ очень значимы во многих отраслях медицины. С целью выявления патологии может назначаться, например, гистология родинки, шейки матки, органов пищеварительного тракта, эндокринной системы и так далее. На наши вопросы о гистологии ответил врач — онколог-маммолог «Клиники Эксперт» Воронеж Сергей Викторович Ежов.
— Сергей Викторович, расскажите, что это за анализ — гистология? В чём его суть?
— Гистологический анализ — это высокоточный метод исследования, позволяющий определить патологическое отклонение в строении ткани. Данный метод используется во многих областях медицины, но его основная суть заключается в том, что с помощью этого метода можно диагностировать наличие злокачественных образований, определить их структуру, а также стадию патологического процесса.
— Что может являться биоматериалом для гистологического исследования?
— Биоматериалом может служить та или иная подозрительная ткань (кожа, слизистая оболочка, мышца, кость), взятая при помощи биопсии, либо препарат, полученный в результате хирургического вмешательства.
— Когда назначается гистология?
— Как я уже говорил, гистологическое исследование может применяться во многих направлениях медицины, но особенная его ценность заключается в определении природы и характера изменений в ткани при малейшем подозрении на онкологический процесс. Также это исследование проводят перед назначением противоопухолевой терапии для разработки плана лечения и во время лечения с целью контроля его эффективности.
— Что показывает гистология?
— Гистологический анализ даёт возможность обнаружить воспалительные процессы в ткани, установить природу того или иного новообразования (т. е. доброкачественное оно или злокачественное), определить уровень злокачественности, а также выявить локализацию первичного опухолевого очага. Надо понимать, что расшифровкой результатов гистологического исследования должен заниматься только специалист. Я бы не рекомендовал пациентам делать это самостоятельно.
Биопсия
— Как сдать анализ на гистологию? Нужна ли специальная подготовка?
— Перед тем, как провести гистологическое исследование, необходимо выполнить биопсию и отправить полученный при этом материал (биоптат) на анализ. Как таковой подготовки биопсия не требует, существует лишь ряд ограничений и рекомендаций, которых нужно придерживаться пациенту накануне и во время забора биоптата. Важно поставить врача в известность обо всех принимаемых препаратах. Накануне исследования необходимо отказаться от лекарственных средств, влияющих на свёртываемость крови (по согласованию с доктором, назначившим их), а также сообщить врачу, который будет выполнять биопсию, о наличии аллергии. Нежелательно проведение данной манипуляции у женщин в дни менструации. Противопоказано употребление алкоголя.
— Как проводится гистология?
— Полученный при биопсии материал помещается в формалин и направляется на гистологическое исследование в патоморфологический центр. Там материал заливается парафином (чаще всего). После остывания, отвердевания делаются тонкие срезы, на которые наносятся различные реактивы для детального изучения ткани под микроскопом врачом-патоморфологом.
— Сколько делается гистологический анализ?
— Если результат очевидный и не вызывает сомнений, выдача заключения производится в среднем через 7-10 дней. При возникающих сомнениях, подозрениях в точности поставленного диагноза препарат могут изучать дольше.
— Бывают ли ошибки в результатах гистологии?
— К сожалению, особенно в небольших населённых пунктах, могут возникать проблемы с качеством проведения гистологического анализа. Это связано с разными причинами (отсутствие врачей, оборудования, расходных материалов). Но в случае появления сомнений в правильности гистологического заключения обычно назначается пересмотр готовых препаратов в другом патоморфологическом центре.
Хотите больше узнать о других видах анализов? Читайте статьи в нашей рубрике
Записаться на приём к онкологу можно здесь
ВНИМАНИЕ: услуга доступна не во всех городах
Беседовала Марина Воловик
Редакция рекомендует:
Предрак: бояться или не обращать внимания?
У страха глаза велики. Так ли опасна миома?
Рак груди — не приговор!
Для справки:
Ежов Сергей Викторович
В 2007 году окончил лечебный факультет Курского государственного медицинского университета.
2007 — 2009 гг. — клиническая ординатура по специальности «Онкология» в Медицинском радиологическом научном центре РАМН г. Обнинск (сегодня — МРНЦ им. А.Ф. Цыба — филиал ФГБУ «НМИЦ радиологии» Минздрава России).
В настоящее время — врач — онколог-маммолог в «Клинике Эксперт» Воронеж.
Приём ведёт по адресу: ул. Пушкинская, 11.
Борисова О.В.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Ермолаева А.Г.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Мельникова В.Ю.
Московский научно-исследовательский онкологический институт им. П.А. Герцена — филиал ФГБУ «Национальный медицинский исследовательский радиологический центр» Минздрава России, Москва, Россия
Петров А.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава РФ
Славнова Е.Н.
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена» Минздрава России
Срочная интраоперационная морфологическая диагностика в онкологии
Авторы:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н.
Как цитировать:
Волченко Н.Н., Борисова О.В., Ермолаева А.Г., Мельникова В.Ю., Петров А.Н., Славнова Е.Н. Срочная интраоперационная морфологическая диагностика в онкологии. Онкология. Журнал им. П.А. Герцена.
2015;4(4):5‑11.
Volchenko NN, Borisova OV, Ermolaeva AG, Melnikova VYu, Petrov AN, Slavnova EN. Rapid intraoperative morphological diagnosis in oncology. P.A. Herzen Journal of Oncology. 2015;4(4):5‑11. (In Russ.)
https://doi.org/10.17116/onkolog2015445-11

Срочная интраоперационная морфологическая диа-гностика (СИМД) — цитологическая и гистологическая — применяется более 100 лет. В последнее время наблюдается общемировая тенденция к снижению количества срочных морфологических исследований во время операции. Это связано с широким применением минимально инвазивных методов получения материала в дооперационной диагностике с целью морфологической верификации процесса, определения факторов прогноза течения заболевания и показаний к назначению адекватной терапии. Благодаря развитию методов уточняющей морфологической диагностики, таких как иммуногистохимия (ИГХ) и цитохимия, и молекулярно-генетических методов расширяются знания об опухолях. Правильный диагноз возможен только при исследовании всего объема опухоли, включая соответствующие ИГХ и молекулярно-генетические исследования. В связи с применением методов уточняющей диагностики показания для СИМД значительно сокращаются. Однако важность срочного морфологического исследования остается несомненной. СИМД по-прежнему играет важную роль, так как определяет тактику хирурга во время операции, позволяет избежать повторных операций или излишне обширных оперативных вмешательств.
Целью интраоперационной морфологической диагностики является адекватное выполнение хирургического вмешательства. Основными задачами срочного интраоперационного морфологического исследования являются:
1) морфологическая верификация диагноза после нескольких неудачных попыток или невозможности дооперационной диагностики, а также при несоответствии морфологического диагноза операционным находкам;
2) уточнение степени распространенности опухолевого процесса путем изучения зон регионарного метастазирования, близкорасположенных органов, состояния органов высокого риска метастазирования, экссудатов и смывов из серозных оболочек;
3) установление абластичности операционных краев резекции;
4) контроль информативности взятого материала при некоторых диагностических операциях.
СИМД имеет ограниченные возможности для уточнения гистогенеза и степени дифференцировки опухоли, для определения характера опухоли (первичная или метастаз), диагностики опухолей кожи, сарком мягких тканей и костей, злокачественных лимфом, опухолевых узлов полиморфного строения, оценки степени лечебного патоморфоза. Не следует применять СИМД при подозрении на cr in situ или микроинвазию.
Показания для срочного цитологического или гистологического исследования определяет оперирующий хирург. Оба метода имеют свои преимущества и недостатки.
По данным литературы [1—6], точность СИМД в зависимости от объекта исследования составляет от 89% при исследовании лимфатических узлов до 98—99% при других локализациях. Ошибочный диагноз при СИМД возможен как ложноположительный, так и ложноотрицательный. Причинами ложноотрицательного морфологического заключения могут быть регрессия опухоли, вызванная неоадъювантной химиотерапией, некроз, замещение опухолевой ткани новообразованными сосудами, гистиоцитами, лимфоцитами и фиброзом, что может быть неправильно истолковано как хроническое воспаление. Причинами ложноположительных заключений являются резко выраженная пролиферация и реактивные изменения клеточных элементов. Эти ошибки могут быть вызваны неправильным толкованием морфологической картины, низким качеством замороженных срезов, неправильным забором материала для исследования, незнанием макроскопических признаков, сложными случаями для интерпретации, наличием только карциномы in situ в образце, гетерогенностью опухоли.
Следовательно, необходимо понимание различных проблем, с которыми может столкнуться как патологоанатом при исследовании замороженных срезов, так и цитолог при СИМД.
Для качественной интраоперационной морфологической верификации диагноза необходимо получение информативного операционного материала, правильное оформление сопроводительных документов с указанием анамнестических данных, стадии процесса, характера предоперационного лечения, сроков его проведения, макро- и микроскопического исследования операционного материала.
Цель исследования — оценить точность СИМД и проанализировать причины диагностических ошибок.
Материал и методы
В 2013 г. ФГБУ «ФМИЦ им. П.А. Герцена» выполнено 418 срочных гистологических исследований у 361 больного (7% общего количества операций) и 1198 срочных цитологических исследований у 646 (12,5%) больных. В 2014 г. выполнено 507 срочных гистологических исследований у 356 (8%) пациентов и 1356 срочных цитологических исследований у 676 (15,5%) пациентов. Для срочного гистологического исследования применяются криостатные срезы, препараты окрашиваются гематоксилином и эозином. Недостатком криостатных срезов является более низкое качество гистологических препаратов, чем при плановом гистологическом исследовании после приготовления парафиновых блоков. Срочное гистологическое исследование проводится в течение 20—30 мин. Для срочной окраски цитологических препаратов применяют набор для окраски Лейкодиф (Чехия). Срочное цитологическое исследование занимает 10—15 мин. Для исследования экссудатов из серозных полостей и диагностики метастатического поражения лимфатических узлов применяется иммунофлюоресцентное исследование (ИФИ) с антителом к эпителиальному антигену Ber-EP4 FITC («Dako»). ИФИ осуществляется на флюоресцентном микроскопе Carl Zeiss Imager M1.
Результаты
Морфологическая верификация диагноза
Интраоперационная морфологическая верификация диагноза применяется в основном при периферических образованиях легких, недоступных для дооперационного морфологического исследования, при опухолях яичников, а также при неуверенном дооперационном морфологическом диагнозе при опухолях молочной железы. Мы придерживаемся правила — не использовать срочное исследование при cr in situ, так как можно не получить категоричного заключения ни при срочном, ни при плановом исследовании.
Гистологическая СИМД для верификации процесса в легком позволила установить туберкулез в 32,8%, гамартому в 8,2%, хроническое продуктивное воспаление в 6,6% наблюдений, что дало возможность избежать излишне радикальных операций. Нейроэндокринные опухоли (типичный и атипичный карциноид) выявлены в 8,2% наблюдений (рис. 1, 2 и далее). Злокачественный процесс установлен в 44,3% наблюдений, при этом 85% составила аденокарцинома легкого, преимущественно высокодифференцированная (прежний БАР) (рис. 3), а 14,8% — метастазы аденокарциномы кишечного типа, желудка и меланомы в ткани легкого. Расхождений срочного и планового гистологического исследований не отмечалось.
При срочном цитологическом исследовании образований в легком гиподиагностика составила 6,7% (4 наблюдения из 60), что связано с получением материала из очага некроза, воспаления, а также наличием микроочагов опухоли на фоне пневмонии. В 6,6% наблюдений цитологически было дано неуверенное заключение.
Опухоли яичников всегда подвергаются СИМД с целью верификации диагноза, что обусловлено отсутствием дооперационной морфологической диагностики — опухоли практически не пунктируют из-за опасности диссеминации. Изучение криостатных срезов является важным диагностическим инструментом определения характера поражений яичников. В 30% наблюдений проведено двустороннее исследование яичников. При СИМД сравнительно просто диагностируют неопухолевые поражения яичников, такие как фолликулярная, лютеиновая, эндометриоидная кисты, эндометриоз и т. д. (54,4%). Доброкачественные опухоли яичников диагностированы в 15,8% случаев, пограничные опухоли яичников (ПОЯ) — в 8,5%, злокачественные — в 21,5%. В одном наблюдении при СИМД диагностирована аденокарцинома яичника, а при плановом гистологическом исследовании установлена тератома. Ошибка связана с выраженной пролиферацией и образованием сосочковых структур эпителиального компонента тератомы. СИМД опухолей яичников имеет ряд ограничений, особенно при ПОЯ, которые характеризуются некоторыми гистологическими особенностями — нарушением стратификации эпителиального пласта, увеличением митотической активности, в некоторых случаях ядерной атипией, но отсутствует стромальная инвазия. СИМД опухолей яичников определяет объем оперативного вмешательства. При доброкачественных и ПОЯ можно выполнить органосохраняющее лечение у молодых женщин, в то время как злокачественные эпителиальные опухоли, как правило, требуют обширного хирургического вмешательства с гистерэктомией, двусторонним удалением придатков матки и сальника, а также тазовой и ретроперитонеальной лимфаденэктомией. При исследовании опухолей яичников необходимо тщательное макроскопическое исследование материала в совокупности с клиническими данными и методами инструментального исследования. Желательно исследовать несколько криостатных срезов из разных участков. По нашим данным, ошибка при исследовании ПОЯ яичников имела характер гиподиагностики и составила 7%, что связано в основном с наличием лишь микроочагов опухоли (рис. 4). Большой размер опухоли, двустороннее поражение, а также муцинозный характер являются неблагоприятными факторами в определении злокачественного потенциала при СИМД. В 20% наблюдений при исследовании брюшины при СИМД выявлены импланты ПОЯ. Если имеются инфаркт и некротические изменения, а также киста, лишенная эпителиальной выстилки, окончательные выводы следует делать при плановом гистологическом исследовании на парафиновых блоках. В 14,3% случаев при СИМД выявлены метастазы в яичниках эндометриоидной аденокарциномы, аденокарциномы шейки матки, желудка, молочной железы и почки, подтвержденные плановым гистологическим исследованием.
Таким образом, чувствительность СИМД при опухолях яичников составляет 98,7%, специфичность — 99%.
Срочное цитологическое исследование яичников применяется при пункции кист или при невозможности гистологического исследования. В одном наблюдении при исследовании кисты цитологически имелась гиподиагностика ПОЯ, что связано с объективными трудностями — клеточная атипия отсутствовала. Однако при пересмотре цитологических препаратов имелись плотные опухолевые комплексы из мелких клеток, что характерно для ПОЯ.
СИМД при образованиях молочной железы в настоящее время применяют крайне редко, так как морфологический диагноз является результатом исследования дооперационных трепанобиопсий. При расхождении цитологического и гистологического диагнозов и при неуверенном дооперационном диагнозе проводится срочное морфологическое исследование. Доброкачественные поражения составили 57%, при плановом гистологическом исследовании подтверждены такие процессы, как аденоз, фиброаденома с дисплазией эпителия. Рак молочной железы установлен в 40% (18 наблюдений), из них 33% составил дольковый рак, в 2 наблюдениях выявлена cr in situ, в одном наблюдении имелся тубулярный рак на фоне склерозирующего аденоза (рис. 5). В другом наблюдении при СИМД диагностирована липогранулема, а при плановом гистологическом исследовании выявлен небольшой очаг инвазивного рака без признаков специфичности. Чувствительность интраоперационного гистологического диагноза при раке молочной железы составляет 97%, специфичность — 100%. Неуверенное заключение дается в 1—2% наблюдений. Противопоказаниями к срочному исследованию являются внутрипротоковый и внутридольковый рак (cr in situ), внутрипротоковая папиллома. Высокодифференцированная папиллярная и тубулярная карцинома, отсутствие клеточной атипии при инвазивном дольковом раке часто при СИМД неправильно диагностируются как доброкачественные поражения как при цитологическом, так и гистологическом исследовании. Инвазивный микрососочковый рак и лимфому молочной железы трудно диагностировать при СИМД.
Случаи гипердиагностики в нашем материале не выявлены, но такие ошибки возможны при пролиферирующем папилломатозе и аденоме соска с гиперплазией эпителия протоков соска с формированием железистых и папиллярных структур, особенно с центральным некрозом, что можно ошибочно принять за внутрипротоковый рак; при склерозирующем аденозе с радиальным рубцом, когда создается впечатление инвазивного роста рака; при гранулематозном мастите, эктазии протоков и некрозе жировых клеток. Для избежания морфологической ошибки необходимо тщательное исследование препарата: отсутствие атипии эпителия, наличие миоэпителиального слоя, плотная коллагеновая строма помогают в постановке правильного морфологического диагноза.
Интраоперационно цитологически опухоли молочной железы исследуют крайне редко: при наличии кист и отсутствии дооперационного морфологического диагноза. В нашем исследовании имелось одно наблюдение, когда цитологически диагностирована папиллярная киста молочной железы, а при плановом гистологическом исследовании диагностирован папиллярный рак.
Цитологическая гиподиагностика при исследовании первичной опухоли составила 3,8%, что связано с утратой морфологических особенностей опухолевых клеток, особенно при недифференцированных и мелкоклеточных новообразованиях (например, мелкоклеточный лимфоцитоподобный рак), а также выраженными дистрофическими изменениями опухолевых клеток. Цитологическая гипердиагностика не превысила 1% и связана с выраженными реактивными изменениями эпителия.
Уточнение степени распространенности опухолевого процесса
С развитием интраоперационного ультразвукового исследования, микрохирургических пособий во время операции, позволяющих обнаружить очаги опухоли, невыявленные на дооперационном обследовании, и интраоперационных находок при непосредственной ревизии операционной раны СИМД имеет неоценимые преимущества. Проведение СИМД в 10% случаев изменяет объем оперативного вмешательства [7]. Невозможность выполнения оперативного вмешательства должна быть подтверждена морфологически.
СИМД позволяет объективно оценить состояние лимфатического коллектора. В 30—40% макроскопически неизмененных лимфатических узлов обнаруживают метастазы, а в 25—30% макроскопически похожих на метастатические узлы при микроскопическом исследовании метастазы не выявляют. Срочное интраоперационное гистологическое исследование лимфатических узлов может быть неудачным в 25% наблюдений [7]. Большое количество ложноотрицательных заключений как цитологических, так и гистологических является серьезной проблемой для клинического применения СИМД в основном из-за ограниченной способности обнаруживать микрометастазы, особенно подкапсульные, которые просто не попадают в срез или соскоб с поверхности разрезанного лимфатического узла. Кроме того, возможна потеря отдельных опухолевых клеток при приготовлении гистологического препарата. Чувствительность и специфичность срочного цитологического исследования лимфатических узлов аналогичны исследованию криостатных срезов, поэтому цитологический метод является альтернативой срочному гистологическому исследованию лимфатических узлов.
В нашем центре проведена работа по исследованию лимфатических узлов при радикальной трахелэктомии у пациенток с начальным раком шейки матки [8]. Удаленные лимфатические узлы подвергали срочному цитологическому исследованию. При обнаружении увеличенных и подозрительных по метастатическому поражению тазовых и парааортальных лимфатических узлов срочное цитологическое исследование дополняли или заменяли срочным гистологическим исследованием. По результатам срочного цитологического и гистологического исследования у 5 (6%) пациенток из 81 выявлены метастазы в лимфатических узлах, в связи с чем произведена конверсия трахелэктомии в расширенную экстирпацию матки с удалением или транспозицией придатков. Метастатическое поражение лимфатических узлов во всех случаях было подтверждено при плановом гистологическом исследовании. В 3 случаях установлены микрометастазы (<2 мм), в 2 — макрометастазы. Число положительных лимфатических узлов варьировало от 1 до 5. Во всех наблюдениях отмечались метастазы плоскоклеточного рака [8].
В настоящее время широко применяется СИМД сторожевого (сигнального) лимфатического узла (СЛУ). Метастатическое поражение СЛУ является одним из основных прогностических и предиктивных факторов при раннем раке желудка, шейки матки, молочной железы и меланоме. СЛУ является первым лимфатическим узлом на пути оттока лимфы от первичной опухоли. Отрицательный СЛУ может исключать возможность метастазов в других лимфатических узлах, что не всегда подтверждается на практике. Например, у женщин с ранним раком шейки матки и молочной железы, которые хотят сохранить репродуктивный потенциал, можно избежать радикального хирургического вмешательства, если в сторожевом узле отсутствует метастаз. Исследование СЛУ проведено гистологически у 4 пациенток при раке шейки матки, метастазов не выявлено; цитологически исследовано 3 СЛУ при раке желудка (у 2) и молочной железы (у 1), метастазов не выявлено.
Причинами гиподиагностики является исследование не всех удаленных лимфатических узлов. Оптимально исследуют не более 5 лимфатических узлов из-за ограничения временны́х рамок. Пролиферация гистиоцитарных элементов при синус-гистиоцитозе с наличием крупных полиморфных гистиоцитов может служить причиной гипердиагностики. Для уточнения диагноза используется ИФИ лимфатических узлов, повышающее достоверность цитологической диагностики до 94%.
Часто для уточнения степени распространенности опухолевого процесса исследуются близкорасположенные органы, брюшина.
Важное значение в оценке степени распространенности опухолевого процесса имеет исследование экссудатов из серозных полостей. Остается сложной и нерешенной задачей цитологического исследования диссеминатов с брюшины при перстневидно-клеточном раке желудка из мелких клеток, ПОЯ, так как эти опухоли при микроскопическом исследовании крайне сложно дифференцировать с реактивным мезотелием. Срочное гистологическое исследование в большинстве наблюдений позволяет установить диссеминацию опухоли. Применение ИФИ повышает выявляемость клеток аденогенного рака до 98% (рис. 6, 7). Из исследованных 150 экссудатов при СИМД ИФИ проведено в 17 (11%) наблюдениях, из них наиболее часто при перстневидно-клеточном раке желудка (12 наблюдений) и ПОЯ (4 наблюдения), что позволило установить диссеминацию опухоли в брюшной полости.
Достоверность СИМД метастазов в печени составляет 98%, гиподиагностика отмечена в одном наблюдении из-за резко выраженной деформации материала. Наиболее часто метастазы в печени выявляют при аденокарциноме желудка и толстой кишки.
Установление абластичности операционного края резекции
Для морфологического контроля абластичности хирургического края интраоперационное исследование имеет важное значение, так как связано с расширением показаний для экономных резекций, особенно при раке молочной железы при трахелэктомии и микрохирургических операциях на органах головы и шеи, а также при раке желудка, толстой кишки, легкого и др.
В настоящее время имеется четкая тенденция к уменьшению расстояния между опухолью и краем резекции. В последние годы появились исследования, показывающие, что сокращения края резекции не приводит к увеличению частоты местных рецидивов и ухудшению выживаемости. По мнению многих исследователей, применение лучевой терапии расширяет возможности оперативного вмешательства.
При раке молочной железы патоморфолог, как правило, дает заключение о негативном крае при расположении опухоли от 1 до 5 мм от края резекции; о позитивном крае, если опухолевые клетки присутствуют в исследуемом материале, и о сомнительном или закрытом крае, когда опухолевые клетки располагаются на расстоянии менее 1 мм от края резекции. При раке молочной железы для срочного гистологического исследования доставляется удаленная опухоль и исследуется один или два края ближайших к опухолевому узлу. Из 87 исследованных краев резекции опухоль обнаружена в 12 (13,8%). В 3 (4%) наблюдениях положительный край резекции установлен только при плановом гистологическом исследовании, что потребовало повторной операции. Факторами, определяющими гистологическую гиподиагностику при СИМД, являются обширный внутрипротоковый компонент и инвазивная дольковая карцинома.
При раке молочной железы проводят срочное цитологическое исследование нижнего и верхнего краев резекции, подсосковой зоны, иногда исследуют медиальный и латеральный края. У 2,5% больных в крае резекции обнаружены опухолевые клетки. Ложноотрицательные цитологические заключения составили 1,2%.
Для исследования краев резекции при раке молочной железы часто доставляется жир, а паренхима молочной железы отсутствует, поэтому адекватно оценить абластичность не представляется возможным.
Оценка края резекции при раке желудка рекомендуется для пациентов при T3 или T4 стадии заболевания, интраоперационно исследуют, как правило, проксимальный край резекции. Срочное гистологическое исследование позволило выявить опухолевый рост в крае резекции при раке желудка в 8% наблюдений. Положительный край был обусловлен инвазией опухоли подслизистого слоя, неопределяемой при макроскопическом исследовании (рис. 8).
При резекции легкого гистологическое исследование краев резекции применяется редко, за 2 года всего 11 наблюдений. Опухолевые клетки обнаружены только в одном наблюдении при неходжкинской лимфоме. Цитологически край резекции бронха исследовали в 17 наблюдениях, опухолевые клетки не обнаружены.
При раке пищевода опухолевые клетки по краю резекции обнаружены в 11,5%, в одном наблюдении опухоль по краю резекции выявлена только при плановом гистологическом исследовании.
Для оценки адекватности удаления шейки матки при трахелэктомии, выполняли поперечный срез толщиной 1—2 мм с ее резидуальной части для срочного гистологического исследования. С помощью CytoBrush из сохраняемого отрезка цервикального канала получали материал с последующим проведением интраоперационного цитологического анализа. Положительная граница резекции интраоперационно установлена у 5 (6%) из 81 больной. В одном случае, по данным срочного гистологического исследования, выявили рак in situ по краю резекции, в связи с чем произвели дополнительное дисковидное иссечение шейки матки, что позволило обеспечить отрицательную границу резекции и выполнить органосохраняющую операцию. В остальных 4 случаях произведена конверсия трахелэктомии в расширенную экстирпацию матки с транспозицией яичников. Положительная граница резекции в 2 случаях из 5 обнаружена при аденокарциноме, в 2 случаях при аденоплоскоклеточном раке и лишь в одном случае при плоскоклеточном гистотипе [8].
Исследование краев резекции при раке поджелудочной железы проведено в 6 наблюдениях, из них в 3 гистологически выявлена аденокарцинома.
В нашем центре широко применяется цитологическое исследование краев резекции при операциях на органах головы и шеи — опухолевые клетки выявлены в 6,8% наблюдений.
С целью определения абластичности краев резекции при онкоортопедических операциях исследование костного мозга на криостатных срезах практически не применяется, поэтому используется срочное цитологическое исследование. Достоверность исследования составляет 98,8%.
В целом 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства, чтобы сделать его адекватным.
Контроль информативности взятого материала при некоторых диагностических операциях
При опухолях мягких тканей и костей, средостения диагноз возможен только при комплексном клинико-морфологическом исследовании с обязательным применением методов иммуногистохимии, а также во многих случаях молекулярно-генетических методов исследования. Интраоперационная морфологическая, в основном цитологическая диагностика применяется с целью контроля информативности взятого материала для планового гистологического исследования и по информативности не уступает исследованию замороженных срезов. По данным некоторых авторов, диагноз был бы невозможен без цитологического исследования. Это, как правило, лимфома, плазмоцитома, саркома Юинга, метастатическая карцинома, метастатическая меланома, рак из клеток Меркеля, липосаркома. Для малоклеточных, фиброзных, миксоидных и опухолей из жировой ткани роль цитологического исследования отпечатков ограничена.
Заключение
СИМД остается незаменимой в онкологии, так как способна уточнить информацию о характере патологического процесса, степени его распространения, состояния окружающих тканей и краев резекции, что необходимо при выборе адекватного хирургического вмешательства. Однако, при неясном диагнозе и при небольшом количестве полученного материала не следует любой ценой добиваться интраоперационного морфологического исследования, особенно если речь идет о редких опухолях и неинвазивном раке.
Чувствительность гистологического метода при СИМД составляет 98%, специфичность — 99%, чувствительность цитологического метода при СИМД составляет 95%, специфичность — 96%. Гистологическая гипердиагностика при срочном исследовании составляет 0,5%, гиподиагностика 1%, цитологическая гипердиагностика — 3%, гиподиагностика — 9%. Заключения в предположительной форме при срочном гистологическом исследовании составляют 2%, при цитологическом — 11%. В 12% результатов интраоперационного морфологического исследования образцов тканей краев резекции показывают необходимость расширения оперативного вмешательства. Неинформативный материал при срочном исследовании достигает 2—5%, в основном при срочном цитологическом исследовании.
Золотым стандартом морфологического исследования является комплексное цитологическое и гистологическое исследования, которые являются взаимодополняющими. Необходимо подчеркнуть значение междисциплинарного подхода к диагностике, в том числе и интраоперационной, включая клинические данные и результаты инструментальных методов исследования с целью достижения точного диагноза.
Участие авторов:
Концепция и дизайн исследования: Н.Н.В.
Сбор и обработка материала: В.Ю.М., А.Г.Е., О.В.Б., Е.Н.С.
Статистическая обработка: О.В.Б., А.Н.П.
Написание текста: В.Н.Н., О.В.Б.
Редактирование: В.Н.Н.
Конфликт интересов отсутствует.